
Rosalie Langenberg
Bijwerkingen
De geschiedenis leert dat regelgevende instanties als de FDA en de EMA slechts onder zeer uitzonderlijke omstandigheden een vaccin van de markt halen. Een voorbeeld waarbij een vaccin door de FDA meteen van de markt werd gehaald, is het zogenaamde Cutter-incident – een ernstig vaccinatieschandaal in de Verenigde Staten in 1955 waarbij een van de producenten, Cutter Laboratories, vaccins leverde waarin het poliovirus niet volledig geïnactiveerd was. Hierdoor werden duizenden kinderen ziek, raakten er ongeveer tweehonderd verlamd en zijn er minstens tien kinderen overleden. Ook RotaShield werd in 1999 van de markt gehaald toen bleek dat het darminvaginatie bij zuigelingen veroorzaakte. Een recenter voorbeeld is het vaccin Pandemrix, dat tijdens de H1N1-pandemie van 2009 werd ingezet en later in Europa door de EMA van de markt werd gehaald na meldingen van narcolepsie bij gevaccineerden. Vaccinatieschade als gevolg van de mRNA-prikken is vaak minder opvallend omdat het om uiteenlopende bijwerkingen gaat, die bovendien vaak pas later optreden (soms jaren later). Daarnaast is er sprake van een aanzienlijke onderrapportage, omdat bijwerkingenregistratiesystemen gebaseerd zijn op vrijwillige meldingen en geen actieve opsporing uitvoeren.
Het V-safeprogramma van het CDC, een mobiel surveillancesysteem om de veiligheid van vaccins te monitoren, dat na een gerechtelijke procedure openbaar moest worden gemaakt, toont aan dat meer dan 7% van de gevaccineerden medische zorg nodig had na de coronavaccinatie. Sinds de uitrol van de coronaprikken heeft VAERS (vergelijkbaar met het Nederlandse Lareb) meer meldingen ontvangen van overlijdens, hartaanvallen, beroertes en blijvende invaliditeit dan in de afgelopen dertig jaar voor álle andere vaccinaties samen. Ook laten onafhankelijke heranalyses van de oorspronkelijke klinische onderzoeken meer ernstige bijwerkingen zien in de behandelde groep dan in de placebogroep. Uit peer-reviewed studies blijkt onder meer dat coronavaccins geassocieerd zijn met een verhoogd risico op myocarditis bij jonge mannen, beroertes bij ouderen, menstruatiestoornissen en auto-immuunziekten. Tevens blijkt uit onderzoek dat in bepaalde vaccinflacons plasmide-DNA-verontreiniging aanwezig is.
Nieuw leiderschap CBER
Nu Peter Marks als hoofd van het Amerikaanse Center for Biologics Evaluation and Research (CBER) is vervangen door Vinay Prasad, die kritisch is op de farmaceutische industrie, breekt er mogelijk een nieuw tijdperk aan. Het CBER is onderdeel van de FDA en verantwoordelijk voor het toezicht op de veiligheid, werkzaamheid en beschikbaarheid van biologische producten in de Verenigde Staten. Marks stapte op vanwege spanningen tussen hem en Kennedy, die hij beschuldigt van het verspreiden van ‘misinformatie en leugens’ over vaccins. Marks wuifde als hoofd van het CBER de zorgen omtrent myocarditis weg en zorgde ervoor dat de boosters versneld werden goedgekeurd. Ook probeerde hij openbaarmaking van de gegevens van V-safe en VAERS tegen te houden.
Prasad staat bekend om zijn scherpe kritiek op de door Big Pharma gedomineerde wetenschap en zijn verzet tegen de opname van Covid-19-vaccins in het standaardvaccinatieschema voor kinderen. Zijn wetenschappelijke publicaties over overmedicalisering en zijn publieke verzet tegen een vaccinatieplicht doen vermoeden dat hij, in tegenstelling tot zijn voorganger, mRNA-vaccins niet zal afschermen van kritisch onderzoek.
Wat kan Kennedy doen?
Hoewel Kennedy niet het alleenrecht heeft om een voorwaardelijke of definitieve goedkeuring in te trekken, zijn er een aantal dingen die hij wel kan doen. Zo kan hij federale contracten voor vaccininkoop stopzetten of via het VRBPAC (Vaccines and Related Biological Products Advisory Committee) een formele beoordeling aanvragen van bestaande autorisaties voor noodgebruik (Emergency Use Authorizations – EUA’s). Verder kan hij het CBER adviseren de veiligheid en effectiviteit van een product opnieuw te beoordelen, juridische acties ondersteunen die de reikwijdte van de PREP Act betwisten, en het algemeen-juridische adviesbureau van het HHS (Department of Health and Human Services) opdracht geven de wettigheid van het voortzetten van een voorwaardelijke goedkeuring te beoordelen in het licht van bekende alternatieven. Tot slot kan hij openlijk steun betuigen aan klokkenluiders binnen de FDA, het CDC en bij vaccinfabrikanten.
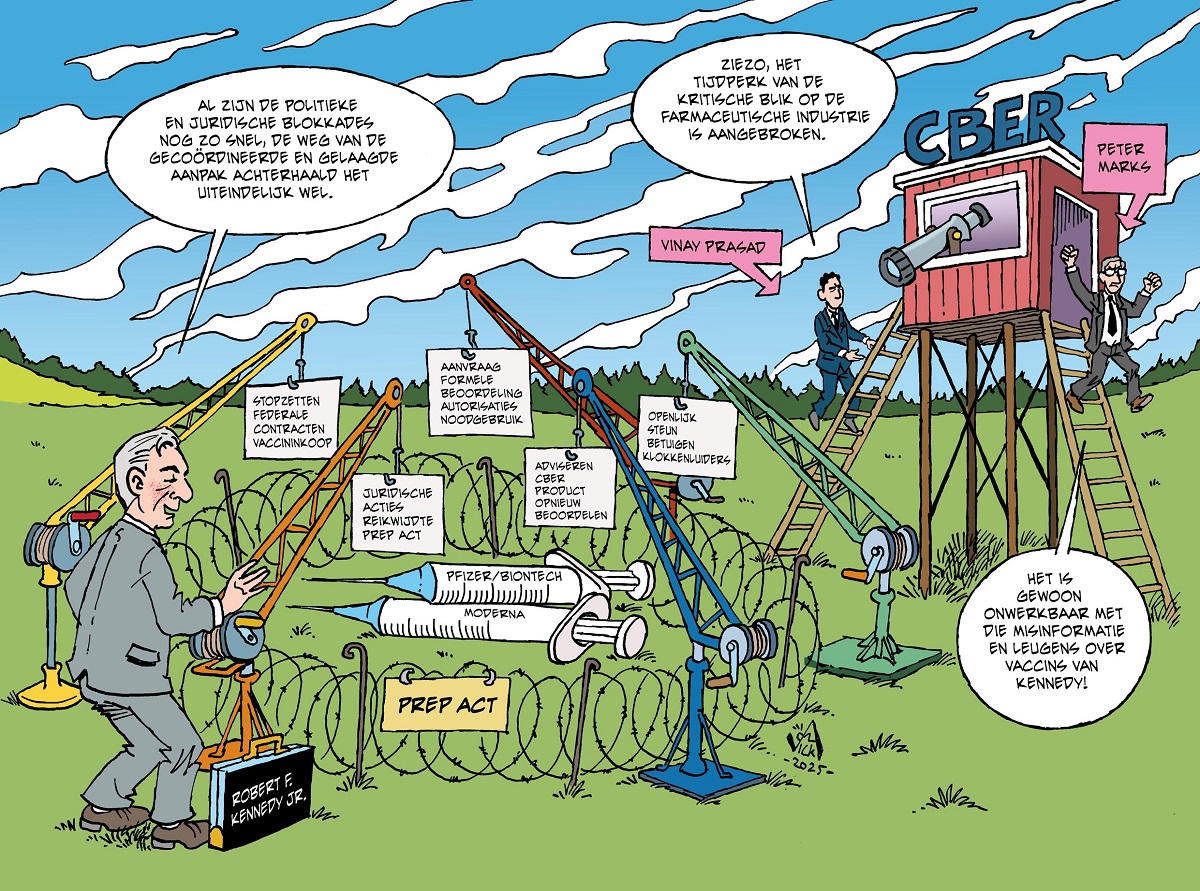
Een aantal van deze routes heeft hij recent al met succes bewandeld. Zo heeft het HHS (Department of Health and Human services) onder Kennedy’s leiding een beleidswijziging doorgevoerd waarbij coronavaccinaties niet langer routinematig worden aanbevolen aan gezonde kinderen en zwangere vrouwen – een duidelijke breuk met eerdere richtlijnen van het CDC. Tevens heeft Kennedy aangekondigd dat nieuwe vaccins, inclusief updates van bestaande coronavaccins, voortaan moeten worden getest in placebo-gecontroleerde onderzoeken voordat ze voor gebruik bij gezonde personen worden goedgekeurd.
PREP Act
De meeste Amerikanen veronderstellen dat de mRNA-vaccins volledig zijn goedgekeurd. Echter, het grootste gedeelte van de toegediende vaccins heeft slechts een voorwaardelijke goedkeuring. Hoewel de FDA een definitieve goedkeuring heeft gegeven voor Comirnaty (Pfizer/BioNTech) en Spikevax (Moderna) bij gebruik van personen vanaf 12 jaar, zijn de vaccins die fysiek beschikbaar zijn in klinieken en apotheken niet altijd gelabeld als ‘Comirnaty’ of ‘Spikevax’. Ze bevatten dezelfde formule, maar vallen onder een voorwaardelijke goedkeuring (EUA) vanwege verschillen in verpakking, distributie of logistiek. Vaccins die onder een EUA vallen genieten onder de in 2005 aangenomen PREP Act bredere bescherming tegen aansprakelijkheid dan volledig goedgekeurde producten.
De PREP Act geeft fabrikanten van medische beschermingsmiddelen ten tijde van afgekondigde noodsituaties een verregaande aansprakelijkheidsbescherming. Echter, als nieuw bewijs naar voren komt dat fraude of nalatigheid aantoont, kan de PREP-vrijwaring vervallen. Zonder de PREP Act kunnen vaccinfabrikanten en zorgverleners makkelijker aansprakelijk worden gesteld voor schadeclaims als gevolg van bijwerkingen. Dit zou een grote stap zijn richting meer transparantie en verantwoordelijkheid.
Recent heeft Kennedy als minister besloten dat alle nieuwe vaccins die bedoeld zijn voor gebruik bij gezonde personen, voortaan gerandomiseerde, placebo-gecontroleerde onderzoeken moeten ondergaan voordat ze door de FDA worden goedgekeurd. Kennedy’s beleid is gebaseerd op het idee dat versnelde goedkeuring (zoals onder de EUA) niet voldoende bewijs levert over veiligheid en effectiviteit bij brede toepassing op gezonde mensen. Bij bestaande vaccins hoeven deze onderzoeken niet met terugwerkende kracht te worden gedaan.
Daarnaast geldt de eis voor gerandomiseerde, placebo-gecontroleerde onderzoeken niet voor bestaande vaccins met een voorwaardelijke (EUA) of volledige goedkeuring (zoals Comirnaty en Spikevax) – alleen voor nieuwe versies of updates van deze prikken.
Het lijkt erop dat Kennedy bewust kiest voor de langere, maar veiliger weg door te wachten op mogelijke rechterlijke toetsing van de immuniteit die vaccinfabrikanten onder de PREP Act genieten, in plaats van zelf beleidsmaatregelen te nemen die politiek of juridisch kunnen worden tegengehouden. Een dergelijke rechtszaak kan alleen door een externe partij (bijvoorbeeld een benadeelde burger of actiegroep) worden aangespannen. Met Prasad als hoofd van het CBER en Kennedy die maximaal gebruikmaakt van de politieke invloed die zijn functie hem als minister toelaat, wordt de basis gelegd voor werkelijke verandering.
– einde artikel –
Je las een Premium artikel uit Gezond Verstand
Volg ons op social media
Kijk en beluister Gezond Verstand via














